候选门辐射群(Candidate Phyla Radiation, CPR)是最近发现的一类基因组极小的专性寄生体,占据了细菌多样性的25%以上,其发现极大地扩展了对微生物“暗物质”的认识。CPR在环境和动物中广泛存在,人类微生物组计划在多个人体部位检测到多种CPR类群。
近日,微生物所杜文斌研究组与北京大学吴晓磊教授研究组、北京大学口腔医院田靖博士合作,开发了基于epicPCR的CPR-宿主原位共生关系挖掘的候选门微生物培养流程,并首次揭示了候选门TM7细菌依靠四型菌毛(T4P)运动和附生宿主的机制。
epicPCR(emulsion, paired isolation, and concatenation PCR)是一种通过皮升乳液微滴实现单细胞分离,并通过单细胞多基因融合扩增,揭示功能基因与系统分类标记基因(如16S rRNA基因)在复杂群落中单细胞水平关联性的技术。在本工作中,团队使用epicPCR来检测CPR与其宿主的体表共生关联,提供直接指导并促进专性表共生TM7细菌与其宿主的靶向分离的新策略,成功从中药蝉蜕分离培养了一株CPR纳米细菌与其放线菌宿主,分别命名为Leucosynbacter cicadicola TM7i和Leucobacter aridicollis J1。
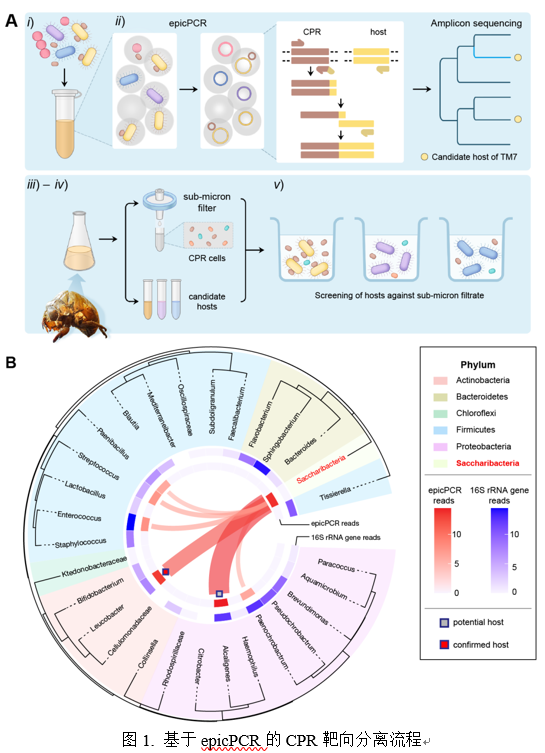
研究发现TM7i细菌专性地寄生于J1的体表,而TM7i基因组内保守的T4P则对其运动与宿主侵染至关重要。利用超高分辨率的成像揭示了CPR细菌是如何与宿主菌发生互作,并首次描述了TM7i完整的寄生生活史。
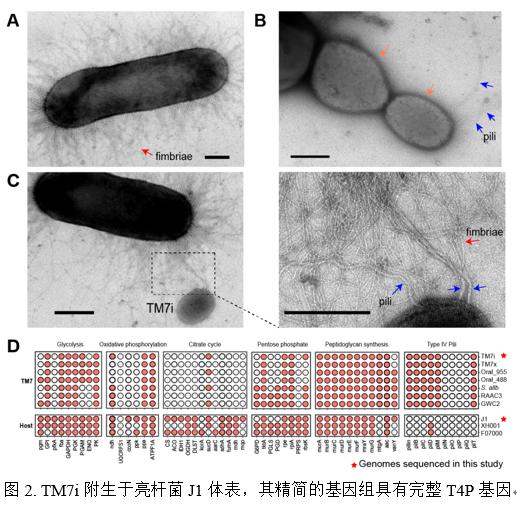
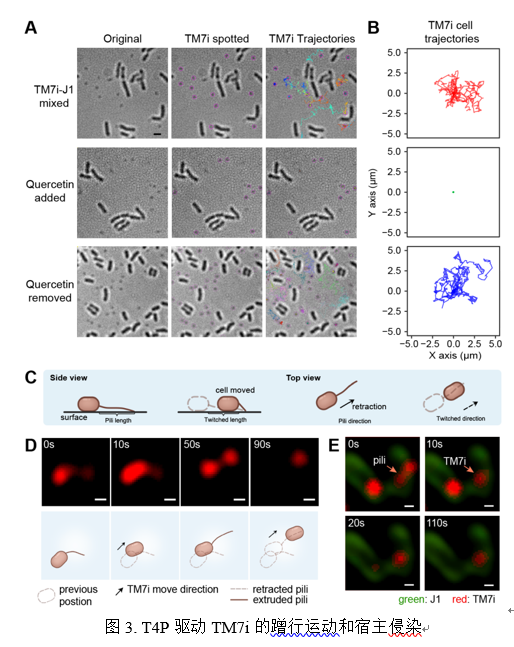
[video:2]
基于显微成像和定量PCR的结果还发现槲皮素可以种群水平上与宿主J1共生期间剂量依赖性地降低了TM7i的生长,表明T4P在TM7i识别和黏附宿主J1方面起着至关重要的作用。
[video:1]
该研究发表在Proceedings of the National Academy of Sciences上,题目为 “Type IV Pili Trigger Episymbiotic Association of Saccharibacteria with Its Bacterial Host”(https://www.pnas.org/doi/10.1073/pnas.2215990119)。微生物所博士生谢冰亮为第一作者,杜文斌研究员为通讯作者。研究得到了国家重点研发计划“难培养和微量病原体靶向培养技术研究”项目(2021YFC2301000)、国家自然科学基金委重大研究计划“水圈微生物驱动地球元素循环的机制”项目(91951103,92251302)等支持。




