上世纪七十年代,美国科学家Woese等提出了三域学说,将地球上的生命分为三种形式(或域),即细菌、古菌和真核生物。古菌常见于高温热泉、盐碱湖、厌氧等极端环境。1984年,德国人Zillig等首次从热泉古菌中分离到了病毒,该病毒形态为此前从未见过的纺锤形(60×100nm),宿主是极端嗜酸嗜热古菌─硫化叶菌(Sulfolobus)。这些纺锤形病毒(Sulfolobus spindle-shaped virus,SSV)属于微小纺锤形病毒科,几乎存在于世界各地的所有高温硫泉中,至今已分离得到20多个病毒株(SSV1~22)。纺锤形是古菌病毒的常见形态,在海洋、盐湖、酸性矿山、极地水体等许多自然环境都已发现。除了形状奇特,纺锤形病毒基因组中约3/4的基因功能未知,这些病毒的衣壳形态构建规则、极端环境适应机制、生活史、与宿主之间的相互作用、起源与进化等成为研究热点。
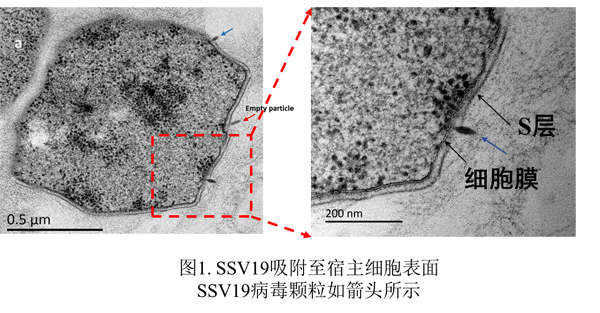
黄力研究团队致力于研究纺锤形病毒和其他古菌病毒,先后发现了包括四株微小纺锤形病毒(SSV19~22)在内的多个新的古菌病毒,并深入探讨了微小纺锤形病毒的感染过程及关键步骤。解析微小纺锤形病毒结构对于理解病毒组装方式、入侵机制和核酸释放等过程非常重要,但是由于此类病毒衣壳通常柔性较大,先前获得的冷冻电镜结构的分辨率都很低,难以看清微小纺锤形病毒的真实面貌。
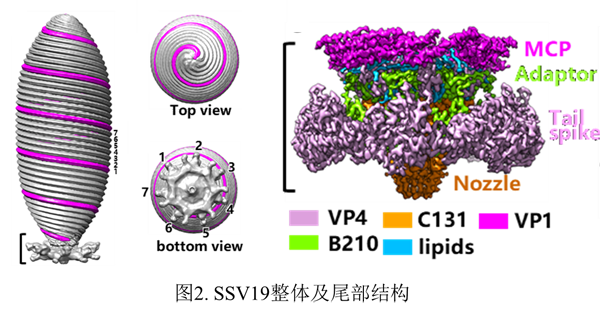
黄力团队与湖南师范大学刘红荣、程凌鹏团队合作,利用近期分离的SSV19,获得了近原子分辨率的病毒颗粒尾部结构。研究发现,SSV19的主要衣壳蛋白(major capsid protein)VP1构成七股螺旋,左手盘绕,组成整个病毒衣壳,病毒颗粒的尾部由七次对称的喷嘴蛋白(nozzle protein)C131、连接蛋白(adaptor protein)B210和尾刺蛋白(tailspike protein)VP4组成。七次旋转对称的病毒衣壳结构属首次发现。在尾部和衣壳之间发现了脂质分子,解开了此类病毒脂质定位之谜。
他们还发现尾刺蛋白含有与细菌甘露聚糖水解酶活性部位相似的结构域,提示该病毒可能通过识别、甚至水解细胞表面的糖链进入宿主细胞。有意思的是,VP1与一种古菌杆状病毒的主要衣壳蛋白结构高度相似,说明纺锤形和杆状病毒衣壳有着共同的结构基础;此外,SSV19的喷嘴蛋白与疱疹病毒和细菌噬菌体的相应蛋白在结构上相似,提示这些感染古菌、真核生物和细菌的病毒可能具有共同祖先。
本研究的结果有助于揭示微小纺锤形病毒颗粒组装、宿主识别与进入、病毒DNA释放等环节的分子细节,增加对古菌病毒及其演化规律的认识。
上述工作已于2022年7月27日在线发表于《美国科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America,PNAS)。黄力研究员、湖南师范大学刘红荣教授、程凌鹏教授为该论文的共同通讯作者。湖南师范大学硕士生韩阵、中国科学院微生物研究所博士生袁琬娟为并列第一作者。该研究得到了国家自然科学基金、湖南省自然科学基金创新群体项目等的资助。
论文链接:https://www.pnas.org/doi/full/10.1073/pnas.2119439119



