近日,中国科学院微生物研究所刘翠华团队和北京胸科医院逄宇团队合作,在Cell Host & Microbe发表了题为“A CLOCK-targeting lncRNA induces trained immunity against tuberculosis”的研究论文,揭示了结核病(tuberculosis,TB)抵抗者来源的外泌体lncRNA通过增强节律核心调控分子CLOCK介导的表观遗传修饰,促进宿主形成抗感染训练免疫的新机制。
训练免疫是指固有免疫细胞通过表观遗传修饰与代谢重编程,对再次刺激产生的长效、非特异性增强反应,但宿主如何通过细胞间通讯协调多细胞免疫应答,进而建立系统性抗感染训练免疫的机制尚不明确。
TB是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的重大慢性传染病。TB抵抗者是一类与患者持续密切接触却未出现感染症状的特殊人群,其缺乏典型的Mtb抗原特异性T细胞免疫应答,提示可能在感染早期通过固有免疫高效清除病原。团队应用多组学分析与功能验证,发现TB抵抗者外周血来源的外泌体lncRNA可诱导单核-巨噬细胞训练免疫,并鉴定出其中一个关键lncRNA,命名为TB resister-derived CLOCK regulator 1(TRCR1)。机制研究表明,在Mtb抗原蛋白刺激下,肺上皮细胞高表达TRCR1并通过外泌体将其释放。被单核-巨噬细胞摄取后,TRCR1通过与RNA结合蛋白FXR2互作,增强CLOCK基因的转录稳定性并提升其蛋白表达水平。随后,CLOCK利用乙酰转移酶活性促进细胞因子编码基因(如TNF、IL1B、IL6)及自噬相关基因(如ATG2A、ULK1、TBK1)的H3K9ac/H3K14ac组蛋白乙酰化修饰,从而增强细胞的固有免疫功能。小鼠模型证实,通过纳米脂质颗粒递送TRCR1进行免疫训练,不仅能增强宿主抵抗Mtb感染的能力,还可提升卡介苗的免疫保护效果。
综上,该研究揭示了上皮细胞与免疫细胞之间通过外泌体lncRNA传递训练免疫信号的新机制。该机制通过增强节律核心调控蛋白CLOCK介导的表观遗传修饰,促进宿主形成系统性的抗感染训练免疫,为TB的临床防治与疫苗优化提供了新思路与新策略。
微生物所刘翠华团队客座博士研究生余珊珊、项目研究员柴琪瑶和博士研究生陆喆为论文共同第一作者,微生物所刘翠华研究员、柴琪瑶项目研究员和北京胸科医院逄宇研究员为论文的共同通讯作者。研究得到国家重点研发计划等项目资助。
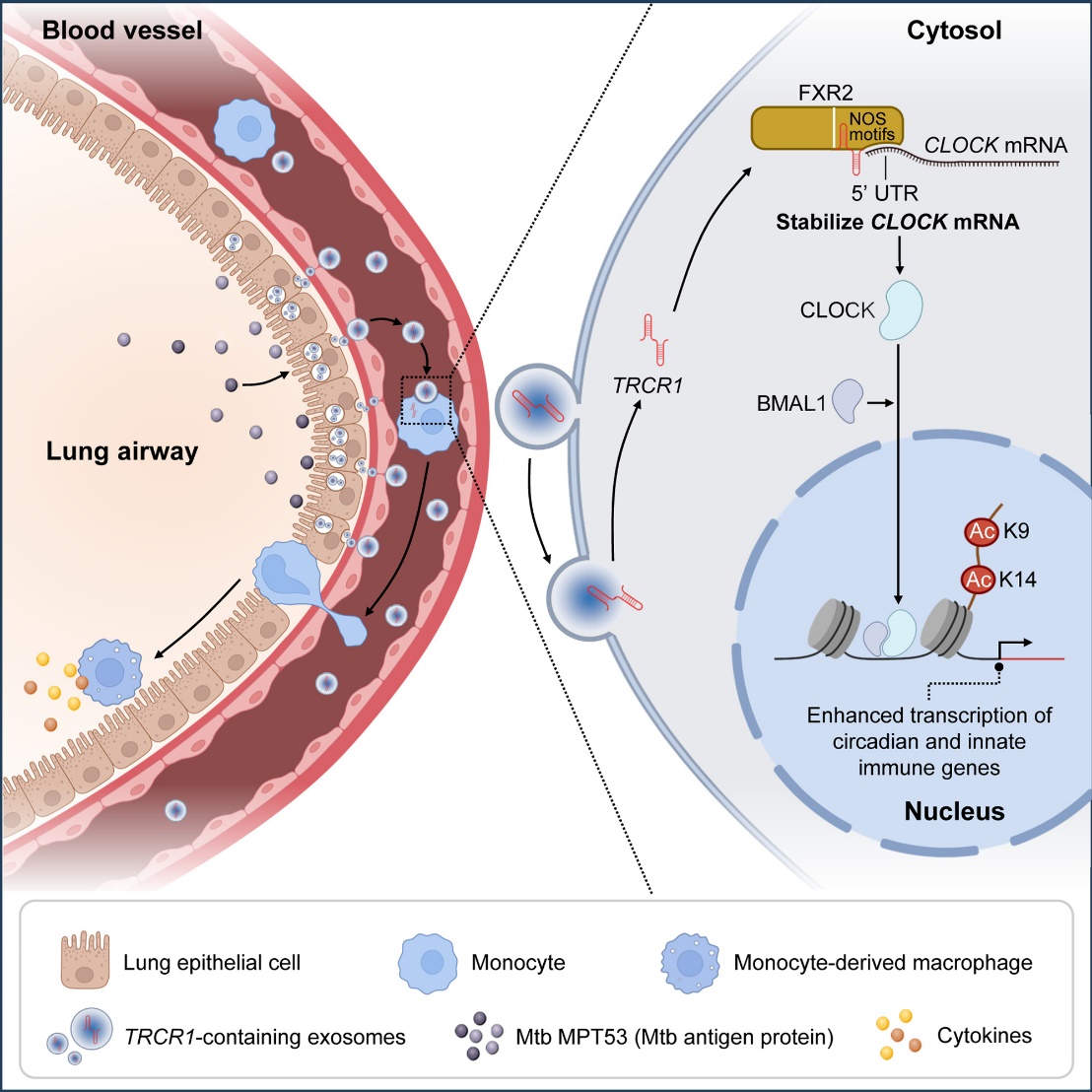
肺上皮细胞分泌的外泌体lncRNA TRCR1促进单核-巨噬细胞训练免疫的机制示意图
文章链接:https://www.sciencedirect.com/science/article/abs/pii/S1931312825005219




